Огненная ртуть Фульминат ртути (химический состав: гремучий ртуть (II)) представляет собой грязную кислую соль ртути. В чистом виде образует бесцветные кристаллы. Молниеносная ртуть ядовита и
история
Огненная ртуть, вероятно, была впервые выделена Кункелем фон Лёвенштерном и другими алхимиками в конце 17 века. Производство ртути, этанола и азотной кислоты было впервые описано в 1799 году англичанином Э. Ховардом .
В то время коллоидная ртуть из-за своей ярко выраженной воспламеняющей способности была наиболее распространенным стартовым взрывчатым веществом. Он использовался в капсулах и детонаторах. Альфред Нобель использовал ртуть в качестве топлива в детонаторах, чтобы поджечь динамит. Именно этот относительно безопасный метод воспламенения обеспечил широкий успех динамитных взрывчатых веществ. Только в Германской империи годовое производство коллоидной ртути в начале 20 века составляло около 100 тонн.
Тем временем, однако, огненная ртуть была заменена другими веществами, такими как азид свинца B .
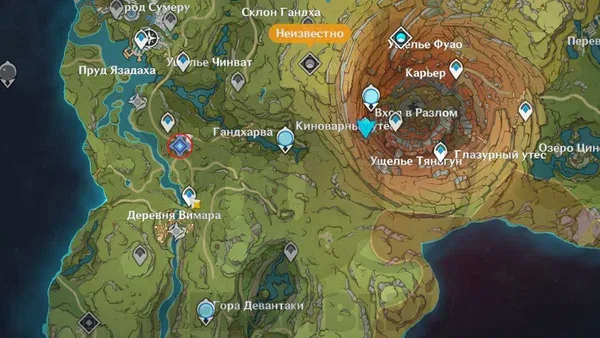
Подробное пошаговое руководство по восьмой локации Sekiro Shadows Die Twice — Sunken Valley, компьютерная игра для ПК, XBox, PS4 в стиле экшн.
Секрет. Основная тропа ведет нас вперед, но мы разворачиваемся и идем в обратном направлении, прыгаем и цепляемся за выступ. Заманивая нас к себе, на нас нападут враги с ружьями. Прыгаем на уступ слева, проходим и снова прыгаем. Мы прижимаемся к стене и идем обратно к локации Окраина Асина. Прыгаем в зону с пирамидами и убиваем призраков самураев в синих костюмах. Рядом со статуями найдите Розарий и Седативное средство. Внутри пещеры есть еще одно успокоительное.
Мини-босс: Без головы. Еще в пещере есть озеро, нырнув в него и немного поплавав, мы увидим привидение. Убиваем его и получаем Благословение Гокана. Также неподалеку кусок трупного жирного воска и божественная трава.
Вы можете вернуться к идолу пешком, используя тот же путь через скалы, или можете телепортироваться к нему. Теперь идем по основному пути. Подбираем Горсть пепла, впереди на уступе воин с ружьем. Запрыгиваем на него и быстро убиваем.

Поднимаемся выше и пересекаем небольшую пещеру. Затем цепляемся за ветку, чтобы стрелой добраться до следующего обрыва. Убиваем его и лезем по скалам слева. Оставляем еще один выступ с врагами. Обязательно поднимите камеру чуть выше, иначе мы потеряем нужные выступы.
Поднимаемся прыжком в сторону холма. На нем палатка, внутри мы найдем тыквенное семечко, а на скале желтая пыль.
Возвращаемся обратно, спускаемся по уступам и проходим пещеры. Мы должны вернуться к Осколку Утеса. Мы прыгаем и спускаемся дальше по тропинке, перед нами Порошок противоядия. Проходим по стене, нас привлекает с помощью крючка ветка, чтобы перебраться на другую сторону. На площадке 2 стрелка с пистолетами и воин с большим дробовиком. Стреляйте постоянно за барабанами. Убиваем его и забираем Магнетит. На этом уступе нет ничего интереснее, кроме нового Идола Резчика на утесе.
МЕРКУРИЙ. (Hydrageryrum), Hg — химический элемент II группы периодической системы элементов; к п. 80, а. 200,59. Серебристо-белый жидкий металл. В соединениях
(Hydrageryrum), Hg — химический элемент II группы периодической системы элементов; к п. 80, а. 200,59. Серебристо-белый жидкий металл. В соединениях он проявляет степени окисления +1 и +2. Природная ртуть состоит из стабильных изотопов 198Hg, 198Hg, 199Hg, 200 Hg, 201Hg, 202Hg и 204Hg. Было получено 18 радиоактивных изотопов, из которых наибольшее практическое значение имеют изотопы 203Hg и 205Hg с периодами полураспада 47 дней и 5,1 минут соответственно.
Ртуть и ее соединения известны с древних времен. Содержание R в земной коре 8,3 · 10-6. Известно около 30 минералов Р., в том числе самородная ртуть и амальгамы различных металлов. Некоторые минералы (киноварь HgS, его метацинабарная разновидность, ливингстонит HgS x 2Sb2S3 и тиманнит HgTe) обнаружены в относительно больших количествах и являются источником промышленной добычи металлов.
Кристаллическая решетка R ромбоэдрическая, расстояние между атомами равно постоянной решетки простейшего ромбоэдра, 2999 A. Атомный радиус 1,60 A, ионный радиус Hg + 1,12 AR — единственный металл, который остается жидким при низкой m-pax (до t-ры — 38,87 ° C).
Потенциалы ионизации Hg ° → Hg + → Hg2 + Hg3 + → H4 + равны соответственно 10,41; 18,55; 32,43 и 45,98 дюйма. Плотность при t-налоге 0 и 20 ° C составляет соответственно 13,5951 и 13,5459 г / см3; тюк t 356,58 ° C; температурный коэффициент объемного расширения твердого тела R в диапазоне от -89,9 до -39,5 ° С изменяется от 12,5 х 10-5 до 17,1 х 10 -5 градусов -1; температурный коэффициент объемного расширения жидкости R в диапазоне от -38,87 до 350 ° С изменяется от 1,823 х 10-4 до 1,889 х 10-4 град -1; теплоемкость (кал / г-град): 0,0339 (т-ра —38,87 ° С); 0,03353 (при температуре 0 ° C); 0,03334 (при 20 ° C); 0,03275 (при 100 ° С) и 0,0324 (при 350 ° С); удельное электрическое сопротивление (t-ры -30; 0 и 20 ° С) соответственно равно 0,91700; 0,94123 и 0,95833 Ом-см. Металлический Р диамагнитен. Вязкость жидкости R. (t-ra 20 ° C) составляет 0,01544 г / см-сек, а поверхностное натяжение составляет 480 дин / см.
Пары ртути с низким m-ts состоят в основном из атомов, с увеличением tt степень ассоциации увеличивается, а критическое t-re почти полностью состоит из двухатомных молекул. Давление насыщенного пара Р. (мм рт. Ст.): 1,447 х 10-8 (т-ра -70 ° С); 2,046 x 10 -4 (при температуре 0 ° C); 1,2979 x 10 -3 (при 20 ° C) и 1,3394 x 10-2 (при температуре 50 ° C). Твердый металл, такой как свинец, можно ковать, протягивать через формы, резать ножом и т.д. Твердость замороженного R по шкале Мооса составляет 1,5.
Сжимаемость жидкости Р. (температура 30 ° С, давление от 1 до 50 бар) 4,051 х 10-6 бар, коэффициент сжимаемости твердой альфа-ртути (т-ра -73 ° С, эталоны, давление) 3,52 Х 10 ат. -1. При низких температурах Р инертен ко многим агрессивным жидкостям и газам, в том числе к атмосферному кислороду. Практически не взаимодействует с концентрированными серными и соляными то-тами, но хорошо растворяется в азотных то-тами, «царской водке», в горячих концентрированных серных таминах.
Окисляется при нагревании на воздухе. Если в металле присутствуют примеси свинца, цинка, меди, кадмия и др., его поверхность покрывается серой оксидной пленкой. С кислородом R образует оксид HgO, имеющий красные и желтые кристаллические модификации, с галогенами образует соединения типа Hg2Г2 и HgГ2 (где это фтор, хлор, бром и йод).
Наиболее важными из них являются хлориды ртути: Hg2Cl2 — каломель — белые кристаллы, малорастворимые в воде, а также HgCl2 — сублимированный — бесцветные водорастворимые кристаллы. Когда R взаимодействует с серой, образуется сульфид HgS, известный в трех вариантах: альфа-киноварь, красный, метацинабарный, черный и бета-киноварь. Метацинабар и бета-киноварь нестабильны и со временем становятся обыкновенной киноварью.
Соли ртути

Из солей R обычного кислорода a — t наиболее важными являются нитраты и сульфаты. Нитрат нитрат Hg2 (NO3) 2 x 2H2O — бесцветные водорастворимые кристаллы. Оксид нитрата Hg (NO3) 2 — желтовато-белые кристаллы, диффундирующие в воздухе. Оксид сульфата Hg2SO4 — белые или бесцветные кристаллы, оксид сульфата HgSO4 — бесцветные кристаллы.
Бесцветные кристаллы цианида Hg (CN) 2 получают растворением оксида HgO в растворе цианида a — te, а также взаимодействием щелочного цианида и двухвалентной соли R. Когда смесь R, азотный концентрат и спирт нагреваются, образуется цианат Hg (CNO) 2 — взрывоопасная ртуть — белые кристаллы, которые взрываются при ударе. Реагируя с металлами, R образует амальгамы.
известно большое количество органических соединений ртути, в которых атомы R напрямую связаны с атомами углерода. Эти соединения используются в органическом синтезе при получении элементоорганических соединений.
Получение ртути
Металл Р в пром-сте получают пирометаллургическим методом гл ир — окислительным обжигом ртутных руд или их концентратов при температуре 700-800 ° С в обожженных, трубчатых, многоподовых и муфельных печах, а также в печах с псевдоожиженным слоем. При обжиге минерала, содержащего, например, киноварь, R восстанавливается до металла, и его пары вместе с сульфидным газом, образующимся при разложении сульфида, попадают в систему конденсации, где газовая смесь охлаждается, пары R конденсируются, а R течет в приемники.
Для получения металла гидрометаллургическим способом сырье, содержащее R в форме сульфида, сначала обрабатывают водным раствором сульфида натрия и гидроксида натрия. Полученный водный раствор соединения HgS x Na2S цементируют алюминием или подвергают электролизу; высвободившийся R фильтруют, а затем перегоняют в вакууме. Очень перспективный метод получения R на основе вакуумного обжига ртутного сырья.
Ртуть высокой чистоты, а также сверхчистый R можно получить при комплексном применении специальной химической очистки, перегонки при пониженном давлении воздуха, электролитического рафинирования в электролизерах с биполярными электродами и последующего перегрева паров R выше 1000 ° С. Металлический R применяется в химии, металлургии, энергетике, электротехнике и радиотехнике, приборостроении и строительстве и др. е химии. Обещанные ртутные катоды используются в электрохимии для получения каустической соды и хлора, а также многих органических соединений.
Амальгама
Способность ртути образовывать амальгаму используется для комплексной переработки полиметаллического сырья методами амальгамной металлургии, для получения высокодисперсных металлических порошков, многокомпонентных сплавов заданного состава, чистых и сверхчистых металлов, содержание примесей в которых не превышает 10-6-10-8%. В энергетике R используется в качестве рабочего тела в мощных бинарных установках промышленного типа, где для генерации Electr энергия используется на первых ступенях ртутных паровых турбин, а на вторых — паровых турбинах.
Кроме того, R используется в ядерных реакторах для отвода тепла. Пары R используются в люминесцентных люминесцентных лампах, а также в ртутных кварцевых лампах низкого, высокого и очень высокого давления. Кроме того, пары R используются в газотронах, газонаполненных тиратронах и триодах. Р особенно используется в вакуумной технике.
Ртутные диффузионные насосы незаменимы для получения сверхвысокого вакуума (примерно 10-13 мм рт. Ст.). В лабораторной практике R используется в барометрах, манометрах, вакуумметрах, термометрах, задвижках, прерывателях, высоковакуумных насосах, всевозможных реле и устройствах контроля температуры.
Применяется как балласт, термостатическая жидкость и герметик. R нашел применение в полярографическом анализе. Ртуть и амальгамы используются при амперометрическом и потенциометрическом титровании, в кулонометрическом анализе. С помощью Р определяется пористость материалов.
R также используется для точной калибровки мерной стеклянной посуды, для определения диаметра капиллярной трубки. Также широко используются соединения железа: например, оксид HgO используется в качестве окислителя при производстве красок; Искусственный сульфид HgS является неотъемлемой частью люминофоров и катализаторов на основе сульфида кадмия в органическом синтезе.
hg Меркурий или Ртуть
Единственный металл, находящийся в жидком состоянии при обычной температуре (точка плавления ртути -38,8 ° C). Он белого цвета и имеет более низкую восстановительную активность, чем цинк. В ряду напряжений ртуть находится справа от водорода, то есть не вытесняет его, не вытесняет из воды и кислот .
Радиус атома ртути почти равен радиусу атома кадмия, а заряд атомного ядра намного больше, поэтому электроны внешнего слоя удерживаются гораздо более сильной ртутью .
Природная ртуть состоит из смеси семи изотопов: 196Hg (диффузный 0,155%), 198Hg (10,04%), 199Hg (16,94%), 200Hg (23,14%), 201Hg (13,17%), 202Hg (29,74%), 204Hg. (6,82%) были также получены радиоактивные изотопы ртути с массовым числом 171-210.
Ртуть легко образует сплавы с другими металлами, которые называются амальгамами, например, с натрием Na, калием K, серебром Ag, золотом Au, платиной Pt, цинком Zn, кадмием Cd, оловом Sn, свинцом Pb, образуя с ними жидкие и твердые сплавы.
В недавнем прошлом золото и серебро получали с помощью ртути, и эти реакции получили название амальгамы золота и серебра. Также на этой основе производится покрытие металлических предметов золотом.
Ртуть химически неактивна и может храниться на воздухе в неизменном виде в течение длительного времени. Однако при длительном слабом нагревании может окисляться, образуя оксид ртути :
При растирании в ступке ртуть очень легко взаимодействует с серой, образуя черный сульфид ртути (II :
Ртуть не реагирует с водой, но хорошо реагирует с азотной кислотой и концентрированной серной кислотой, которые в этом случае оказывают сильное окислительное действие, в зависимости от температуры, при которой проводится реакция, образуются как соли ртути, одновалентные, так и двухвалентные. И одновалентные, и двухвалентные соединения ртути довольно стабильны, хотя могут переходить друг в друга.
Ртуть очень токсична, легко испаряется даже при комнатной температуре и может вызвать тяжелое отравление, оказывающее сильное воздействие на сердце. При попадании соединений ртути внутрь происходит нарушение деятельности пищеварительной системы и почек. Соединения ртути, такие как хлорид ртути, также очень ядовиты.
Применение ртути
В промышленности он используется как металл и некоторые его соли. Металлическая ртуть используется в производстве термометров, барометров, в некоторых измерительных приборах, а также при извлечении золота для очистки его от примесей, поскольку ртуть легко образует амальгамы с золотом и некоторыми другими благородными металлами. Он также использовался в стоматологическом кабинете для изготовления пломб.
Медицинское применение в качестве дополнения к крему от вшей.
Соли ртути также находят некоторое применение, поскольку хлорид ртути HgCl2 используется в качестве дезинфицирующего средства, но в последнее время другие способы применения означают, что каломель Hg2Cl2 (Cl — Hg — Hg — Cl) используется в качестве мягкого слабительного.
В природе ртуть редко встречается в естественном жидком состоянии, но в форме соединений, таких как киноварь HgS. Для получения ртути киноварь сначала обжигают :
а затем образовавшийся оксид ртути HgO разлагается при нагревании :
Обычно обе реакции протекают одновременно в одном процессе; Оксид серебра обладает такими же свойствами при нагревании, он восстанавливается до свободного состояния.
Химические свойства ртути
В нормальных условиях ртуть существует в жидком состоянии. Сплавы с другими металлами с образованием амальгамы. Жидкая ртуть устойчива на воздухе и в воде, но не покрыта защитной оксидной пленкой. Эти свойства ртути согласуются с ее высоким потенциалом ионизации .
Ртуть, которая находится в ряду напряжений справа от водорода, растворяется только в концентрированной азотной кислоте и горячей концентрированной серной кислоте, образуя соответствующие соли :
Когда разбавленная азотная кислота воздействует на избыток ртути, образуется нитрат ртути (I) :
Атомы ртути (в отличие от цинка и кадмия) могут связываться друг с другом ковалентными связями, образуя группу Hg: Hg ·. Каждый атом ртути в этом комплексе имеет степень окисления 1+. Окислители легко увеличивают степень окисления ртути :
и восстановители превращают Hg2 в Hg2 и, кроме того, в металлическую ртуть ;
Гидроксиды ртути очень нестабильны и разлагаются уже в процессе реакции :
Нагрев приводит к восстановлению до свободного металла:
Все соединения ртути чрезвычайно токсичны, и в случае разлива ртути она может быть связана (нейтрализована) с серой. Поэтому места налива ртути присыпают серной пылью или для «демеркуризации» также используют раствор хлорида железа FeCl3
Источники
- https://deru.abcdef.wiki/wiki/Knallquecksilber
- https://zone-xyz.ru/opustivshayasya-dolina
- https://znaesh-kak.com/x/ba/rtut